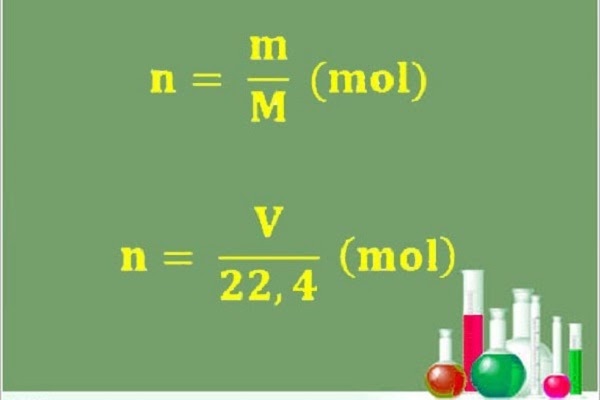Số mol là một khái niệm cơ bản tỏng chương trình hoá học phổ thông. Vậy khái niệm số mol là gì và cách tính số mol của các chất như thế nào? Chúng ta sẽ tìm hiểu chi tiết về vấn đề này ngay sau đây.
Đang xem: Số mol là gì, Đơn vị, công thức tính khối
Khái niệm số mol là gì?
Mol được gọi là một đơn vị đo lường cơ bản thuộc vào hệ quy chuẩn SI và được sử dụng riêng cho các hạt vĩ mô. Nó cách khác, mol chính là lượng chất có chứa số hạt đơn vị của phân tử hoặc nguyên tử chất đó. Cụ thể nó diễn tả lượng chất có chứa 6,022×10^23 số hạt đơn vị của phân tử hoặc nguyên tử chất đó.
Lưu ý, khối lượng mol của phân tử không giống khối lượng mol của nguyên tử. Ví dụ, khối lượng mol phân tử (hydro) là 2g trong khi khối lượng mol của nguyên tử H (hydro) chỉ là 1g.
Cách phân biệt kí hiệu:
1 mol H chỉ 1 mol nguyên tử Hidro.
1 mol H2 chỉ 1 mol phân tử Hidro.
Lịch sử phát triển của mol
Do được sử dụng phổ biến trong hóa học nên mol cũng là một trong những đơn vị có mối quan hệ mật thiết với đơn vị khối lượng nguyên tử, phân tử khối, hằng số Avogadro cũng như các khái niệm khác có trong hóa học.
Năm 1805, xuất bản bảng giá trị nguyên tử khối tương đối đầu tiên trên thế giới được nhà khoa học John Dalton (1766–1844) xuất bản.
Sau đó, bảng giá trị nguyên tự khối tương đối được Jöns Jacob Berzelius (1779–1848) tìm hiểu và đưa ra những thông số chính xác hơn.
Thế hệ tiếp theo tiếp tục mở rộng công trình của Berzelius phải kể tới Henri Victor Regnault (1810–1878), Charles Frédéric Gerhardt (1816–1856) và Stanislao Cannizzaro (1826–1910).
Tên gọi mol xuất hiện chính thức vào năm 1894, tên này được bắt nguồn từ tiếng Đức (molekül có nghĩa là phân tử), do nhà khoa học Wilhelm Ostwald đặt. Trong từ điển Merriam-Webster, người ta cho rằng mol được đặt dựa theo từ gốc molekulärgewicht của tiếng Đức có nghĩa là khối lượng phân tử.
Tính đến thời điểm hiện tại, mol đã được sử dụng rất phổ biến trong những lĩnh vực liên quan đến hóa học, phân tử, nguyên tử…
Công thức tính số mol của một chất nhất định
Để tính số mol của một chất nào đó, ta sẽ áp dụng công thức sau:
n = m/M
Trong đó:
n là số mol chất, đơn vị: molM là khố lượng mol, đơn vị: g/molm là khối lượng chất đó, đơn vị: g
Khố lượng mol của một chất được hiểu là khối lượng tính bằng gam của N nguyên tử hoặc phân tử của chất đó.
Khối lượng mol nguyên tử hay phân tử của một chất có cùng số trị với nguyên tử khối hoặc phân tử khối của chất đó.
Thể tích mol chất khí là gì?
Thể tích mol phân tử của một chất khí chính là thể tích 1 mol phân tử của chất khí đó, hoặc có thể là thể tích bị chiếm mới N phân tử chất đó. Trong điều kiện nhiệt độ và áp suất không thay đổi thì thể tích mol chất khí cũng không đổi. Điều kiện tiêu chuẩn khi nhiệt độ là 0 độ C và áp suất là 1 atm thì 1 mol chất khí sẽ tương đương với thể tích 22,4 lít.
Trong điều kiện tiêu chuẩn, các tính mol sẽ tính theo công thức sau:
n = V/22,4
Trong đó:
n chính là số molV là thể tích khí ở điều kiện tiêu chuẩn22,4 là hằng số trong điều kiện tiêu chuẩn.
Trong trường hợp chất khí ở trạng thái tự nhiên, không phải là điều kiện tiêu chuẩn thì công thức trên không thể áp dụng. Chúng ta sẽ cần tới những công thức và phép tính phức tạp hơn.
Một mol của bất kì chất khí nào trong cùng điều kiện nhiệt độ, áp suất đều chiếm những thể tích bằng nhau.
Xem thêm: Một Số Cấu Trúc Với Từ ' Use Of Là Gì Trong Tiếng Anh? Phân Biệt Cách Dùng Use
Trên đây là toàn bộ những thông tin chi tiết để giải đáp thắc mắc số mol là gì. Việc nắm rõ cách tính số mol của một chất sẽ giúp bạn dễ dàng giải quyết những bài toán khó. Bên cạnh đó, đây cũng chính là cơ sở để bạn thực hiện tích toán khi tiến hành thí nghiệm hoá học. Hy vọng rằng bạn đọc sẽ có cho mình những kiến thức thật hữu ích.