Các em đã biết tính chất hóa học của Hidro qua bài viết trước, bài viết này chúng ta sẽ làm quen với khái niệm về sự Oxi hóa, sự khử và phản ứng Oxi hóa khử trong đó có sự tham gia của Hidro.
Đang xem: Tính khử là gì, tính oxi hóa là gì
Vậy sự khử là gì? sự Oxi hóa là gì? và Phản ứng Oxi hóa khử xảy ra như thế nào? Hidro đóng vai trò gì trong phản ứng Oxi hóa khử, là chất Oxi hóa hay chất khử chúng ta cùng tìm hiểu qua bài viết này.
I. Sự Oxi hóa và Sự khử
1. Sự khử là gì?
– Định nghĩa: Sự khử là sự tách oxi ra khỏi hợp chất
* Ví dụ: CuO + H2 → Cu + H2O
– Trong PTPƯ trên, ta thấy H đã kết hợp với nguyên tố oxi tạo thành H2O, hay H chiếm oxi của CuO.
2. Sự Oxi hóa là gì?
– Định nghĩa: Sự Oxi hóa là sự tác dụng của Oxi với một chất.
* Ví dụ: Fe + O2 → Fe3O4
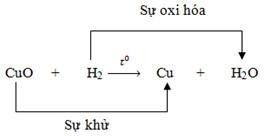
II. Chất khử và chất Oxi hóa
– Chất khử là chất chiếm oxi của chất khác.
– Chất oxi hóa là đơn chất oxi hoặc chất nhường oxi cho chất khác.
* Ví dụ 1: CuO + H2 Cu + H2O
– Ta có: Chất khử là: H2 và chất Oxi hóa là CuO
* Ví dụ 2: Mg + CO2 MgO + C
– Ta có: Chất khử là: Mg và chất Oxi hóa là CO2
III. Phản ứng Oxi hóa khử là gì?
– Định nghĩa: Phản ứng Oxi hóa khử là phản ứng trong đó xảy ra đồng thời sự Oxi hóa và sự Khử.
* Ví dụ:

IV. Tầm quan trọng của phản ứng Oxi hóa – khử
– Phản ứng Oxi hóa – khử được sử dụng trong công nghiệp luyện kim, công nghiệp hóa học.
– Tuy nhiên, phản ứng Oxi hóa khử cũng cũng có phản ứng không có lợi, cần phải hạn chế.
V. Bài tập về phản ứng Oxi hóa – Khử
Bài 1 trang 113 SGK hóa 8: Hãy chép vào vở bài tập những câu đúng trong các câu sau đây:
A. Chất nhường oxi cho chất khác là chất khử.
B. Chất nhường oxi cho chất khác là chất oxi hóa.
C. Chất chiếm oxi của chất khác là chất khử.
D. Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có xảy ra sự oxi hóa.
E. Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có xảy ra đồng thời sự oxi hóa và sự khử.
* Lời giải bài 1 trang 113 SGK hóa 8:
– Các câu đúng: B, C, E.
– Các câu sai: A, D vì những câu này hiểu sai về chất khử, chất oxi hóa và phản ứng oxi hóa – khử.
Bài 2 trang 113 SGK hóa 8: Hãy cho biết trong những phản ứng hóa học xảy ra quanh ta sau đây, phản ứng nào là phản ứng oxi hóa – khử? Lợi ích và tác hại của mỗi phản ứng?
a) Đốt than trong lò: C + O2 → CO2.
b) Dùng cacbon oxit khử sắt (III) oxit trong luyện kim.
Fe2O3 + 3CO → 2Fe + 3CO2.
c) Nung vôi: CaCO3 → CaO + CO2.
d) Sắt bị gỉ trong không khí: 4Fe + 3O2 → 2Fe2O3.
* Lời giải bài 2 trang 113 SGK hóa 8:
– Các phản ứng oxi hóa – khử là a), b) ,d).
– Phản ứng a) Lợi: sinh ra nhiệt năng để sản xuất phục vụ đời sống. Tác hại: sinh ra khí CO2 làm ô nhiễm môi trường.
– Phản ứng b) Lợi: luyện quặng sắt thành gang điều chế sắt. Tác hại: sinh ra khí CO2làm ô nhiễm môi trường.
– Phản ứng d) Tác hại: Làm sắt bị gỉ, làm hư hại các công trình xây dựng, các dụng cụ và đồ dùng bằng sắt.
Bài 3 trang 113 SGK hóa 8: Hãy lập các phương trình hóa học theo các sơ đồ sau:
Fe2O3 + CO → CO2 + Fe.
Fe3O4 + H2 → H2O + Fe.
CO2 + 2Mg → 2MgO + C.
– Các phản ứng hóa học này có phải là phản ứng oxi hóa – khử không? Vì sao? Nếu là phản ứng oxi hóa – khử cho biết chất nào là chất khử, chất oxi hóa? Vì sao?
* Lời giải bài 3 trang 113 SGK hóa 8
Fe2O3 + 3CO → 3CO2 + 2Fe.
Fe3O4 + 4H2 → 4H2O + 3Fe.
CO2 + 2Mg → 2MgO + C.
– Cả 3 phản ứng đều là phản ứng oxi hóa – khử.
– Các chất khử là CO, H2, Mg vì đều là chất chiếm oxi.
– Các chất oxi hóa là Fe2O3, Fe3O4, CO2 vì đều là chất nhường oxi.
Xem thêm: Ufm Là Trường Gì Về Đại Học Tài Chính, Giải Đáp “1001” Thắc Mắc Về Trường Ufm!
Bài 4 trang 113 SGK hóa 8: Trong phòng thí nghiệm người ta đã dùng cacbon oxit CO để khử 0,2 mol Fe3O4 và dùng khí hiđro để khử 0,2 mol Fe2O3 ở nhiệt đô cao.
a) Viết phương trình hóa học của các phản ứng đã xảy ra.
b) Tính số lít khí ở đktc CO và H2 cần dùng cho mỗi phản ứng.
c) Tính số gam sắt thu được ở mỗi phản ứng hóa học.
* Lời giải bài 4 trang 113 SGK hóa 8:
a) Phương trình hóa học của các phản ứng:
4CO + Fe3O4 → 3Fe + 4 CO2 (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b)Theo phương trình phản ứng trên ta có:
– Muốn khử 1 mol Fe3O4 cần 4 mol CO.
⇒ Muốn khử 0,2 mol Fe3O4 cần x mol CO.
⇒ x= 0,2.4 = 0,8 (mol) CO.
⇒ VCO = n.22,4 = 0,8.22,4 = 17,92 (lít).
– Muốn khử 1 mol Fe2O3 cần 3 mol H2.
⇒ Muốn khử 0,2 mol Fe2O3 cần y mol H2.
⇒ y = 0,2.3 = 0,6 mol.
⇒ VH2= n.22,4 = 0,6.22,4 = 13,44 (lít).
c) Ở phản ứng (1) khử 1 mol Fe3O4 được 3 mol Fe.
– Vậy khử 0,2 mol Fe3O4 được 0,2.3=0,6 mol Fe.
⇒ mFe = n.M = 0,6.56 = 33,6g Fe.
Ở phản ứng (2) khử 1 mol Fe2O3 được 2 mol Fe.
Vậy khử 0,2 mol Fe2O3 được 0,4 mol Fe.
mFe = n.M = 0,4 .56 = 22,4g Fe.
Bài 5 trang 113 SGK hóa 8: Trong phòng thí nghiệm người ta dùng khí hiđro để khử sắt(II) oxit và thu được 11,2 g Fe.
a) Viết phương trình hóa học của phản ứng đã xảy ra.
b) Tính khối lượng sắt (III) oxit đã phản ứng.
c) Tính thể tích khí hiđro đã tiêu thụ (đktc).
* Lời giải bài 5 trang 113 SGK hóa 8:
a) Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
b) Theo bài ra, ta có:
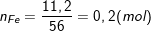
– Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
– Theo PTPƯ, khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol Fe.
⇒ x = 0,2/2 =0,1 mol.
⇒ m = n.M = 0,1.160 =16g.
– Khử 1 mol Fe2O3 cần 3 mol H2.
– Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
⇒ V= n.22,4 = 0,3 .22.4 = 6,72 (lít).
Xem thêm: Giới Thiệu Total Commander Là Gì, Total Commander 9
Hy vọng với bài viết về Phản ứng Oxi hóa – khử, sự Oxi hóa, sự khử là gì và bài tập ở trên hữu ích cho các em. Mọi góp ý và thắc mắc các em vui lòng để lại bình luận dưới bài viết để gocnhintangphat.com ghi nhận và hỗ trợ, chúc các em học tập tốt.