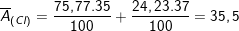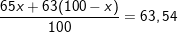Các em đã biết về cấu tạo của nguyên tử qua bài học trước, trong bài này chúng ta sẽ tìm hiểu chi tiết hơn về hạt nhân nguyên tử, số khối, nguyển tử khối trung bình của các nguyên tốt hoá học và đồng vị.
Đang xem: Số khối là gì, số hiệu nguyên tử là gì
Vậy hạt nhân nguyên tử có số khối là bao nhiêu, có mỗi liên hệ nào giữa điện tích hạt nhân với số proton và số electron? nguyên tố hoá học và đồng vị là gì, nguyên tử khối và nguyên tử khối trung bình được tính như thế nào? Tất cả sẽ được giải đáp qua bài viết dưới đây.
I. Hạt nhân nguyên tử
1. Điện tích hạt nhân
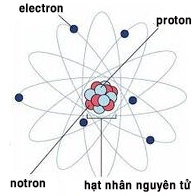
– Hạt nhân gồm các hạt proton và nơtron. Nếu hạt nhân có Z proton, thì điện tích của hạt nhân bằng Z+ và số đơn vị điện tích hạt nhân bằng Z.
– Nguyên tử trung hòa về điện nên số proton trong hạt nhân bằng số electron của nguyên tử. Vậy trong nguyên tử:
Số đơn vị điện tích hạt nhân Z = số proton = số electron.
– Ví dụ: Số đơn vị điện tích hạt nhân nguyên tử Oxi là 8, vậy nguyên tử Oxi có 8 proton và 8 electron.
2. Số khối
– Số khối (kí hiệu là A) là tổng số hạt proton (kí hiệu là Z) và tổng số hạt nơtron (kí hiệu là N) của hạt nhân đó: A = Z + N
– Ví dụ: Hạt nhân nguyên tử Natri có 11 proton và 12 nơtron. Vậy số khối của hạt nhân nguyên tử Natri là A = 11+12=23.
II. Nguyên tố hóa học
1. Nguyên tố hoá học là gì?
• Định nghĩa: Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân.
⇒ Như vậy, tất cả các nguyên tử của cùng 1 nguyên tố hóa học đều có cùng số proton và cùng số electron.
– Ví dụ: Tất cả các nguyên tử có cùng số đơn vị điện tích hạt nhân là 6 đều thuộc nguyên tố Cacbon. Các nguyên tử Cacbon đều có 6 proton và 6 electron.
• Những nguyên tử có cùng điện tích hạt nhân đều có tính chất hóa học giống nhau.
– Cho đến nay, người ta đã biết 92 nguyên tố hóa học có trong tự nhiên và khoảng 18 nguyên tố nhân tạo được tổng hợp trong các phòng thí nghiệm hạt nhân.
2. Số hiệu nguyên tử
– Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số hiệu nguyên tử của nguyên tử đó.
3. Kí hiệu nguyên tử
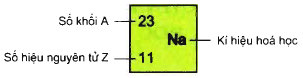
– Số đơn vị điện tích hạt nhân và số khối được coi là những đặc trưng cơ bản của nguyên tử. Để kí hiệu nguyên tử, người ta thường ghi các chỉ số đặc trưng ở bên trái kí hiệu nguyên tố X với số khối A ở bên trên, số hiệu nguyên tử Z ở bên dưới.
– Số hiệu nguyên tử (kí hiệu là Z) cho biết:
° Số proton trong hạt nhân nguyên tử
° Số electron trong nguyên tử.
• Nếu biết số khối (A) và só hiệu nguyên tử (Z), ta biết được số proton, số nơtron (N = A – Z) có trong hạt nhân nguyên tử và số electron của nguyên tử đó.
– Như hình trên, ta có A = 23; Z = 11 nên suy ra số p = e = 11, vậy số nơtron N = A – Z = 23 – 11 = 12. Vậy trong hạt nhân nguyên tử natri có 12 nơtron
III. Đồng vị
– Các nguyên tử của cùng 1 nguyên tố hóa học có thể có số khối khác nhau vì hạt nhân của các nguyên tử đó có cùng số proton nhưng có thể có số nơtron khác nhau.
⇒ Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số nơtron, do đó số khối A của chúng khác nhau.
– Các đồng vị được xếp vào cùng một ô nguyên tố trong bảng tuần hoàn.
– Phần lớn các nguyên tố hóa học là hỗn hợp của nhiều đồng vị. Ngoài khoảng 340 đồng vị tồn tại trong tự nhiên, người ta đã tổng hợp được hơn 2400 đồng vị nhân tạo. Các đồng vị của cùng một nguyên tố hóa học có số nơtron trong hạt nhân khác nhau, nên có một số tính chất vật lí khác nhau.
– Người ta phân biệt các đồng vị bền và không bền. Hầu hết các đồng vị có số hiệu nguyên tử lớn hơn 82 (Z > 82) không bền, chúng còn được gọi là các đồng vị phóng xạ. Các đồng vị, đặc biệt là đồng vị phóng xạ, được sử dụng nhiều trong đời sống, nghiên cứu y học,…
IV. Nguyên tử khối và nguyên tử khối trung bình
1. Nguyên tử khối
– Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
Xem thêm: Tariff Là Gì ? Định Nghĩa, Ví Dụ, Giải Thích Customs Tariff Là Gì
– Khối lượng của một nguyên tử bằng tổng khối lượng của proton, notron và electron trong nguyên tử đó
2. Nguyên tử khối trung bình
– Hầu hết các nguyên tố hóa học là hỗn hợp của nhiều đồng vị với tỉ lệ phần trăm số nguyên tử xác định, như vậy:
⇒ nguyên tử khối của các nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỉ lệ phần trăm số nguyên tử tương ứng
– Giả sử nguyên tố có 2 đồng vị X và Y. kí hiệu X, Y đồng thời là nguyên tử khối của 2 đồng vị, tỉ lệ phần trăm số nguyên tử tương ứng là a và b. Khi đó, công thức tính nguyên tử khối trung bình
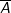
của nguyên tố là:
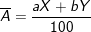
– Trong những phép toán không cần độ chính xác cao, có thể coi nguyên tử khối bằng số khối.
* Ví dụ: Clo là hỗn hợp của 2 đồng vị bền
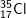
chiếm 75,77% và
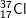
chiến 24,23% tổng số nguyên tử Clo trong tự nhiên, nguyên tử khối trung bình của Clo là:
V. Bài tập về hạt nhân nguyên tử, nguyên tố hoá học
Bài 1 trang 13 sgk hoá 10: Nguyên tố hóa học là những nguyên tử có cùng
A. Số khối. B. Số notron.
C. Số proton. D. Số notron và số proton.
– Chọn đáp án đúng.
* Lời giải bài 1 trang 13 sgk hoá 10:
– Đáp án đúng: C. Số proton.
Bài 2 trang 13 sgk hoá 10: Kí hiệu nguyên tử biểu thị đầy đủ các đặc trưng cho một nguyên tử của một nguyên tố hóa học vì nó cho biết:
A. Số khối.
B. Số hiệu nguyên tử Z.
C. Nguyên tử khối của nguyên tử.
D. Số khối A và số hiệu nguyên tử Z.
– Chọn đáp án đúng.
* Lời giải bài 2 trang 13 sgk hoá 10:
– Đáp án đúng: D. Số khối A và số hiệu nguyên tử Z
Bài 3 trang 14 SGK hóa 10: Nguyên tố cacbon có hai đồng vị:
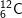
chiếm 98,89% và
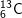
chiếm 1,11%. Nguyên tử khối trung bình của cacbon là:
a) 12,500. b) 12,011.
c) 12,022. d) 12,055.
Chọn đáp án đúng.
* Lời giải bài 3 trang 14 SGK hóa 10:
– Đáp án đúng: B. 12,011.
– Ta có:
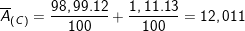
Bài 4 trang 14 SGK hóa 10: Hãy xác định điện tích hạt nhân, số proton, số nơtron, số electron, nguyên tử khối của các nguyên tử thuộc các nguyên tố sau:
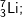
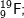
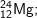
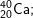
* Lời giải bài 4 trang 14 sgk hoá 10:
– Bảng sau thể hiện số số proton, số nơtron, số electron, nguyên tử khối của các nguyên tử đã cho:
– Điện tích hạt nhân nguyên tử: Z
– Nguyên tử khối: A
– Áp dụng công thức: số nơtron (N) = số khối (A) – số hiệu nguyên tử (Z)
| Nguyên tố | điện tích hạt nhân | Số P | Số N | Số E | A |
| Li | 3+ | 3 | 7-3 = 4 | 3 | 7 |
| F | 9+ | 9 | 19-9 = 10 | 9 | 19 |
| Mg | 12+ | 12 | 24-12 = 12 | 12 | 24 |
| Ca | 20+ | 20 | 40-20=20 | 20 | 40 |
Bài 5 trang 14 SGK hóa 10: Đồng có hai đồng vị bền và . Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm số nguyên tử của mỗi đồng vị
* Lời giải bài 5 trang 14 SGK hóa 10:
– Gọi x là thành phần % của đồng vị thì (100-x) là % của đồng vị , ta có:
⇒ x = 27%
⇒ % = 27% còn % = 73%.
Bài 6 trang 14 SGK hóa 10: Hidro có nguyên tử khối là 1,008. Hỏi có bao nhiêu nguyên tử của đồng vị trong 1ml nước (cho rằng trong nước chỉ có đồng vị và )? (Cho khối lượng riêng của nước là 1g/ml).
* Lời giải bài 6 trang 14 SGK hóa 10:
– Gọi % đồng vị là x thì % đồng vị là (100-x):
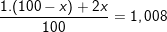
⇒ x = 0,8
⇒ % = 0,8%
– Theo bài ra, khối lượng của 1ml H2O: 1gam
⇒ MH2O = 2.1,008 + 16 = 18,016u
⇒ Khối lượng của 1 mol H2O là 18,016g.
⇒ Số mol của 1g H2O là:
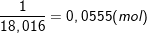
⇒ Số nguyên tử H có trong 1ml H2O là: 2.0,0555.6,022.1023 = 6,68442.1022 nguyên tử
⇒ Số nguyên tử chiếm: 6,68442.1022.
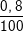
= 5,35.1020 nguyên tử
Bài 7 trang 14 SGK hóa 10: Oxi tự nhiên là một hỗn hợp các đồng vị: 99,757% 16O; 0,039% 17O; 0,204% 18O. Tính số nguyên tử của mỗi loại đồng vị khi có 1 nguyên tử 17O
* Lời giải bài 7 trang 14 SGK hóa 10:
– Giả sử có 10000 nguyên tử O thì số nguyên tử của mỗi đồng vị là:
99,757% 16O ⇒ 99757 nguyên tử 16O
0,039% 17O ⇒ 39 nguyên tử 17O
0,204% 18O ⇒ 204 nguyên tử 18O
– Khi có một nguyên tử 17O thì số nguyên tử:
16O là:
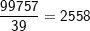
nguyên tử.
18O là:
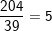
nguyên tử.
Xem thêm: Thể Vàng Là Gì ? Nghĩa Của Từ Thể Vàng Trong Tiếng Việt Chương Trình Bông Sen Vàng
Bài 8 trang 14 SGK hóa 10: Agon tách ra từ không khí là hỗn hợp ba đồng vị: 99,6% 40Ar;0,063% 38Ar; 0,337% 36Ar. Tính thể tích của 10g Ar ở điều kiện tiêu chuẩn
* Lời giải bài 8 trang 14 SGK hóa 10:
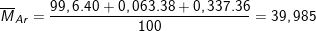
⇒
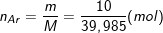
⇒
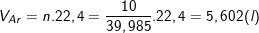
* Hoặc cũng có thể tính như sau:
22,4 lít Ar ở đktc có khối lượng 39,985 g
x lít Ar ở đktc có khối lượng 10 g
⇒
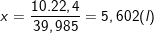
Hy vọng với bài viết về Điện tích hạt nhân, số khối, nguyên tử khối trung bình của nguyên tố hoá học ở trên hữu ích với các em. Mọi thắc mắc và góp ý các em vui lòng để lại bình luận dưới bài viết để gocnhintangphat.com ghi nhận và hỗ trợ, chúc các em học tập tốt.